Le gène Wt1 contrôle la détermination ovarienne
- Recherche
- Culture scientifique
le 6 novembre 2023
Deux équipes de l’Institut de Biologie Valrose (Université Côte d'Azur, CNRS, Inserm) viennent d'identifier un facteur essentiel à l’initiation du développement ovarien. Ce facteur est un variant d’épissage du gène Wt1, dont le rôle est primordial dans la détermination du sexe. Ces travaux ont été publiés dans la prestigieuse revue Science le 2 novembre 2023.
Chez la plupart des mammifères, le sexe est déterminé lors de la fécondation. La mère transmet le chromosome sexuel X tandis que le père transmet un chromosome X ou Y. Ainsi l’embryon XX devient une femelle tandis qu’un individu XY devient un mâle par le processus appelé « détermination du sexe ». Ce processus permet à la gonade indifférenciée de se développer en ovaire ou en testicule respectivement, initiant ainsi tout le développement sexuel de l’individu.
Chez les individus XY, le programme de différenciation testiculaire est gouverné par le gène Sry, localisé sur le chromosome Y. Sry active différents gènes cibles dont Sox9, qui est nécessaire à la différenciation des cellules de soutien mâles, les cellules de Sertoli. Ces cellules sont non seulement nécessaires au développement du testicule mais également à la mise en place et au maintien de la spermatogenèse.
Chez la femelle, le maintien de la différenciation ovarienne nécessite Rspo1, un activateur de la voie de signalisation WNT/ß-catenin et le facteur de transcription FOXL2. Cependant, les mécanismes d’initiation du programme de différenciation de l’ovaire demeuraient énigmatiques jusqu'à aujourd’hui. L’analyse des patients affectés par des différences de développement sexuel suggère qu’un des gènes importants pour la détermination du sexe est le gène WT1 (Wilms’ tumor suppressor). Lors de l’expression de ce gène, l’épissage alternatif entre les deux derniers exons génère deux variants dépourvus ou non des trois acides aminés KTS (lysine, thréonine et sérine) et nommés –KTS et +KTS respectivement. Les mutations conduisant à un déséquilibre de la production de ces variants sont responsables du syndrome de Frasier, qui se caractérise par la féminisation de l’appareil génital des patients XY.
Pour analyser le rôle de ces isoformes +KTS et -KTS dans le développement de la gonade, Elodie Gregoire, de l’équipe « Détermination du sexe et fertilité » de l’institut de Biologie Valrose, a revisité des modèles de souris n’exprimant qu’une de ces deux isoformes et a montré que :
- l’absence de -KTS empêche la différenciation des cellules de soutien femelles, les cellules de la granulosa et tout développement de l’ovaire. Les cellules restent bloquées à un stade de cellules progénitrices.
- la surexpression de -KTS active le développement ovarien empêchant l’activation du gène Sry dans la gonade XY. Cette gonade ne devient pas un testicule mais un ovaire (Figure 1).
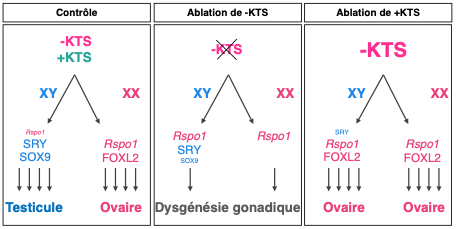
Figure 1. Modèle de différenciation des cellules de soutien dans les gonades de type sauvage et mutantes KTS : L’absence de -KTS dans les gonades induit une dysgénésie gonadique alors que sa surexpression entraîne une différenciation ovarienne quelque soit le sexe génétique XX ou XY.
• Copyrights de la vignette : Elodie Gregoire
• Copyrights de la figure : Elodie Gregoire et Marie-Christine Chaboissier
- Pour en savoir plus
-
The −KTS splice variant of WT1 is essential for ovarian determination in mice
Gregoire E.P., De Cian M.C., Migale R., Perea-Gomez A., Schaub S., Bellido-Carreras N., Stevant I., Mayere C., Neirijnck Y., Loubat A., Rivaud P., Llorian Sopena M., Lachambre S., Linssen M.M., Hohenstein P., Lovell-Badge R., Nef S., Chalmel F., Schedl A. et Chaboissier M.C.
Science 2023, sous presse - Contact :
-
Marie-Christine Chaboissier - Directrice de recherche CNRS
marie-christine.CHABOISSIER@univ-cotedazur.fr
Elodie Grégoire - Ingénieure d’étude INSERM
Elodie.gregoire@univ-cotedazur.fr
Institut de Biologie Valrose (iBV)
Université Cote d’Azur – Parc Valrose – 06108 Nice




